前言骨在人体内部主要起到支撑作用,是一种具有愈合和再生能力的硬组织[1]。由于骨的密度大、硬度高、破损后很难自然修复等特殊性,必须进行骨移植。钛合金因具有轻质、弹性模量与人骨相近、耐腐蚀、生物相容性好等优点[2−3],被广泛应用于工程机械、航空航天和生物医学领域[4]。但是TC4基体对于金黄色葡萄球菌的抗菌率仅为14.5%[5],且钛及钛合金具有生物惰性,与骨骼机械结合的方式会导致摩擦产生碎屑,最终引发炎症,从而导致植入手术失败[6]。相对于在提高钛合金种植体材料的骨结合、耐磨性和耐蚀性方面的研究,针对钛合金骨科植入体细菌感染的研究仍处于早期阶段[7]。
植入手术术后感染是植入失败的主要原因之一,细菌引起的相关植入物感染风险从0.4%到16.1%不等[8]。引起细菌感染的重要原因是生物膜的形成[9]及由粘附的微生物聚集产生致密的胞外聚合物[10]。因此,防止或降低生物膜在植入过程中的形成具有重要作用。
目前,对于提高钛及钛合金植入材料抗菌性能的表面改性途径包括涂覆抗生素、制备有机抗菌剂和无机抗菌剂涂层等技术来达到灭菌的作用[11]。研究发现,钛合金表面制备依诺沙星涂层[12]、庆大霉素-HA涂层[13]、膦酸盐/季铵盐共聚物涂层[14]等有机抗菌剂涂层对钛合金的抗菌性能都有较大程度的提高。但是,抗生素、有机抗菌剂的大量使用会导致细菌产生耐药性且药物作用时间较短[15]。无机抗菌剂主要包括Ag+,Cu2+,Zn2+,Co2+等,能够在人体内稳定发挥作用且具有优良的抗菌性能和生物相容性。目前,在钛合金中添加无机抗菌金属元素的技术主要包括电弧熔炼、真空等离子烧结、离子注入、气相沉积和激光表面改性技术等,将无机抗菌剂掺入合金体系或者表面,使植入材料获得抗菌性能。其中,激光表面改性技术具有独特的技术优势,相对于电沉积、PVD/CVD技术,与基体材料具有较强的结合力。相对于热喷涂技术,具有较小的热影响区[16],对基材的影响较小。因此,激光表面改性技术具有广阔的应用潜力。
激光表面改性技术既可以通过高温热源对表面进行重熔引发合金相转变或构建表面纹理化来提高表面性能,又可以结合外源物质制备具有不同性能的表面涂层[17]。激光作为一种新型能源,具有局部选择性、能量密度高、节省材料、凝固快、稀释率低、热影响区窄、冶金结合强度高等优点[18],也可以对合金的组织形态和析出相进行调控[19],被广泛应用于材料加工领域。激光表面改性技术作为一种无机抗菌剂植入技术,在表面工程中具有广泛的应用前景。
钛及钛合金作为主要的骨科植入材料,其抗菌性的研究成为重中之重,如何利用激光表面改性技术,改善植入物的抗菌性能成为现阶段的研究热点。文中综述了激光表面改性技术的分类,以及采用激光表面改性技术对钛及钛合金进行表面合金化、表面织构和激光熔覆处理,研究激光表面改性方式对钛合金抗菌性能的影响并对抗菌机理进行解释。
1、激光表面改性技术
激光表面改性技术利用激光热源与金属或非金属进行相互作用,通过添加相同或不同材料或对材料表面进行重熔来改善基体的表面性能,是一种清洁、安全、高效率的加工技术[20],是光学、冶金学、电子学、计算机学等为一体的高新技术,在现阶段具有广阔的应用前景。
激光表面改性技术主要包括表面硬化、激光重熔、织构化和激光熔覆等,分类如图1所示。
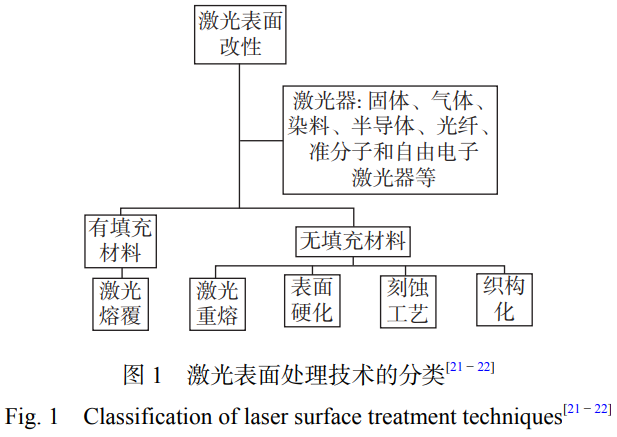
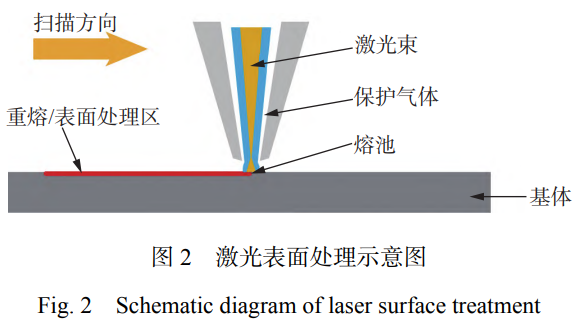
激光表面处理技术在保护气氛或者无保护气条件下对材料进行表面加热或重熔,可以对材料表面进行定向处理,其原理如图2所示。激光表面处理包括激光重熔、激光合金化、激光纹理化和激光微纳加工等技术。固体材料在受到激光束的作用下,有助于通过诱导微观结构变化来进一步提高抗菌性能、表面硬度、耐磨性、耐腐蚀性等性能,从而实现表面改性[23]。同时,激光表面处理可应用于制备微纳加工结构、改善金属表面性能和加强固体材料粘结强度等方面。
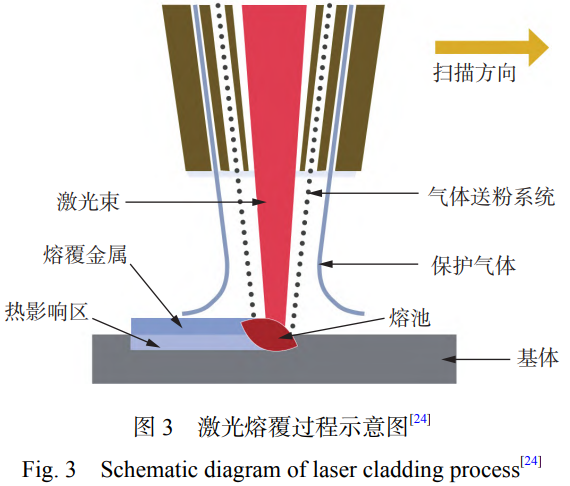
激光熔覆技术是利用激光束的高能量密度,将基体材料熔化形成熔池,由保护气体携带金属粉末或丝材同时注入熔池,从而将其熔覆在受热区域表面,形成具有冶金结合的功能性涂层,提高材料的表面性能,其原理如图3[24]所示。激光熔覆技术是上世纪90年代以来快速发展的表面改性技术,现阶段已经得到广泛应用[18]。激光熔覆技术具有热输入能量集中、热影响区小、变形小、基体能够与熔覆层形成冶金结合、熔覆层稀释率低等优点[25−26]。激光熔覆技术主要应用于提高基体耐磨性、耐蚀性、抗菌性和耐高温性能等[27]。
2、激光表面处理钛合金抗菌涂层
激光本质上是电磁波的一种,按照波长可分为紫外光、可见光和红外光[28]。根据激光器功率的不同,选择不同波长的激光对钛及钛合金进行处理。现阶段,波长小于355nm的短波长激光可以对钛及钛合金进行切割;波长为532nm的绿光激光多用在医疗领域对钛及钛合金激光加工处理。激光表面处理技术主要通过改变钛合金的表面化学成分和表面结构,对钛合金植入物的抗菌性能进行调控。
在激光表面处理过程中,由于合金元素、表面结构和熔覆体系的不同,对激光表面处理钛及钛合金的结构和性能有不同程度的影响,从而达到不同的抗菌效果。
2.1 激光表面合金化
激光表面合金化技术(LSA)是利用激光热源将基材熔化形成熔池,将高性能合金粉或气体与基体发生反应形成一层新的合金化层,从而使材料具有高性能[29]。
通过激光表面合金化技术在合金表面添加适当含量的抗菌元素,可改变材料表面的合金成分。同时,由于激光能量可以熔化涂层和部分底层基体,激光表面合金化技术可以在合金层和基体之间形成牢固的冶金结合。QIAO等学者[30]使用波长较短(0.9μm)的高功率二极管激光器制备了TiNi与Ag的激光合金化涂层。研究表明:通过合金化技术可以使涂层中含有更多的Ti2Ni,β-Ti和Ag颗粒;在银含量(质量分数)为4.6%时,涂层的硬度提高了109%;同时,合金化后涂层释放的Ag+和Ag颗粒显著提高了对大肠杆菌和金黄色葡萄球菌的抗菌效果。
在激光处理过程中,保护气体不仅可以降低空气中氧气和水分等对激光表面处理的干扰和污染,提高表面处理的质量和效率[31],还可以与基体发生反应,形成合金化涂层。由于氮和钛在热力学上存在有利的相互作用,形成的氮化层对钛合金的硬度和摩擦学性能有很大的提高[32]。钛的氮化物(TiN)、氧化物(TiO2)等[31]都具有本征抗菌性能。邹洁等学者[33]在牙科钴铬合金表面制备一层2.5μm厚度的TiN涂层,之后对涂层进行耐腐蚀和抗菌性试验,发现:TiN涂层对变形链球菌或黏性放线菌有很好的抗菌性能。
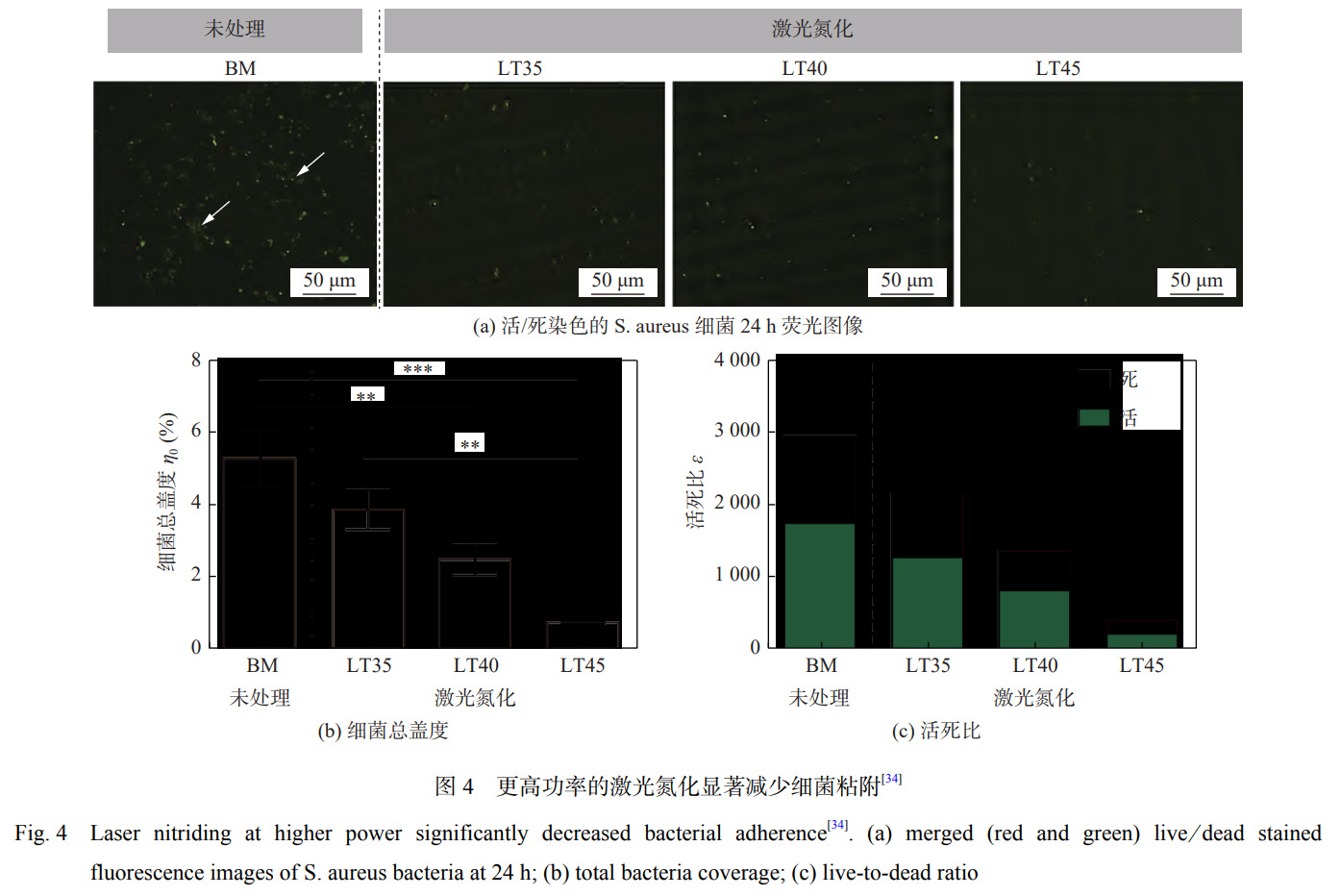
DONAGHY等学者[34]利用光纤激光技术在高纯N2保护下对TNZT(Ti-35Nb-7Zr-6Ta)合金进行处理,研究激光氮化处理对合金表面形貌、粗糙度、润湿角以及抗菌性能的影响。结果表明:激光氮化处理后XRD检测到较强的TiN峰值强度,能够显著提高表面粗糙度至1180.2nm,润湿角降低至27.1°,亲水性和生物相容性进一步提高,其抗菌效果如图4[34]所示,合金表面细菌覆盖率降低至0.72%。
钛及钛合金相对于其他材料抗菌和耐腐蚀的主要优点是可以在表面生成一层TiO2陶瓷膜[35]。研究表明:钛合金在正常温度下暴露1年,所形成的TiO2氧化膜的厚度为6nm,且与基体结合性很差,在较低的剪切力作用下就会被破坏[7]。激光表面处理可以改变氧化膜的厚度和表面粗糙度,进而提高合金的性能。
FATHI-HAFSHEJANI等学者[36]在氧气氛围内对钛合金进行激光表面改性处理,钛合金基体表面形成物相和形貌可控的高纯度TiO2涂层。由于晶体TiO2涂层产生的光催化活性,具有不同相(锐钛矿、金红石)和不同形态的TiO2涂层在增强骨整合和抗菌行为方面表现出优异的性能。PARMAR等学者[37]通过对TC4进行纳秒激光和氧化处理。研究表明:纳秒激光处理表面发生微坑形式的物理和化学变化,表面电荷发生变化,Ti的氧化物含量增加,氧化可以促进激光微织构对金黄色葡萄球菌的粘附和增殖能力的抑制。
钛与空气中的碳、氢等都有非常高的反应活性。CUNHA等学者[38]在空气中对钛进行激光表面处理,在进行XPS检测时,发现其有较高的碳峰,原因是空气中含有较多的含碳污染物[39]。氩气作为一种常见的惰性保护气体,其多用于激光焊接和激光熔覆过程中防止有益元素的烧损和合金化[40],在钛及钛合金表面激光处理用以提高抗菌性能中的应用较少。
2.2 激光表面织构
激光表面织构技术可以对钛合金进行表面结构设计或者进行重熔处理,改善钛及钛合金的表面结构。现阶段,通过激光表面织构技术可以在钛及钛合金表面制备微米和纳米尺寸的结构或纹理结构,进而影响合金表面的氧化膜厚度和表面粗糙度,降低表面载流子数量、提高表面峰度,有效地减少细菌的黏附或灭活细菌[41]。
纳米级表面特征有利于减少细菌黏附和生长。CHAN等学者[7]通过连续波光纤激光器发射波长为1064nm近红外激光对商业纯钛(cp-Ti)和TC4进行激光表面处理诱导纳米特征结构的产生,其处理后表面如图5所示。激光处理表面由波纹和放射状片层构成的玫瑰状标记组成,2种钛合金均表现出较强的抗菌性能。从表面疏水性、膜成分、厚度和粗糙度等方面对抗菌机理进行解释:①研究发现,金黄色葡萄球菌是疏水性的,其水接触角为72.2°[42],而经过激光处理的表面表现出更强的亲水性,水接触角降低到30°~45°,减少了细菌的接触。②细菌与植入物表面接触是在表面电荷与细菌的静电相互作用下进行吸引,使细菌黏附在植入物表面,在氮气环境中进行激光表面处理会增大表面膜层的厚度,减少表面载流子的数量[43]。同时,表面膜层中存在大量的缺陷和空位,会造成电荷的富集,减少与细菌的相互作用[7]。③激光表面织构会增加材料的表面粗糙度,相同的表面粗糙度具有不同的峰度(Rku)和偏度(Rsk)[44],激光处理的钛合金表面具有更高的峰度和偏度,使表面有更多的“尖刺”,减少细菌黏附的原理与蝉翼的杀菌作用相似[45],通过细菌与材料的相互作用将其吸附在表面,导致细菌的破裂和裂解。

CUNHA等学者[38]采用Yb:KYW激光器、发射波长为1030nm、脉冲持续时间为500fs的激光,在钛合金表面构建了激光诱导周期性表面纹理结构(LIPSS)和纳米柱2种表面织构,其表面结构如图6所示,其Ra值分别为0.3μm和0.5μm,润湿角分别为12.6°和32.1°。对其进行细菌培养试验,未经激光处理试样表面细菌覆盖率为25%,激光处理后试样表面金黄色葡萄球菌的覆盖率为7%,对于细菌的生长有较好的抑制作用。研究表明:金黄色葡萄球菌优先附着于1~4nm的钛合金表面[46],在Ra为5~8μm的样品上形成的生物膜比在抛光(Ra=30nm)或机加工(Ra=0.5μm)表面上更强烈[47]。细菌优先粘附在粗糙度较高的表面,但也粘附在形貌特征大于细菌尺寸(一般为1~2μm)的表面。因此,激光诱导周期性表面纹理结构可以通过改善钛合金表面的润湿角和粗糙度降低细菌的黏附和增殖。
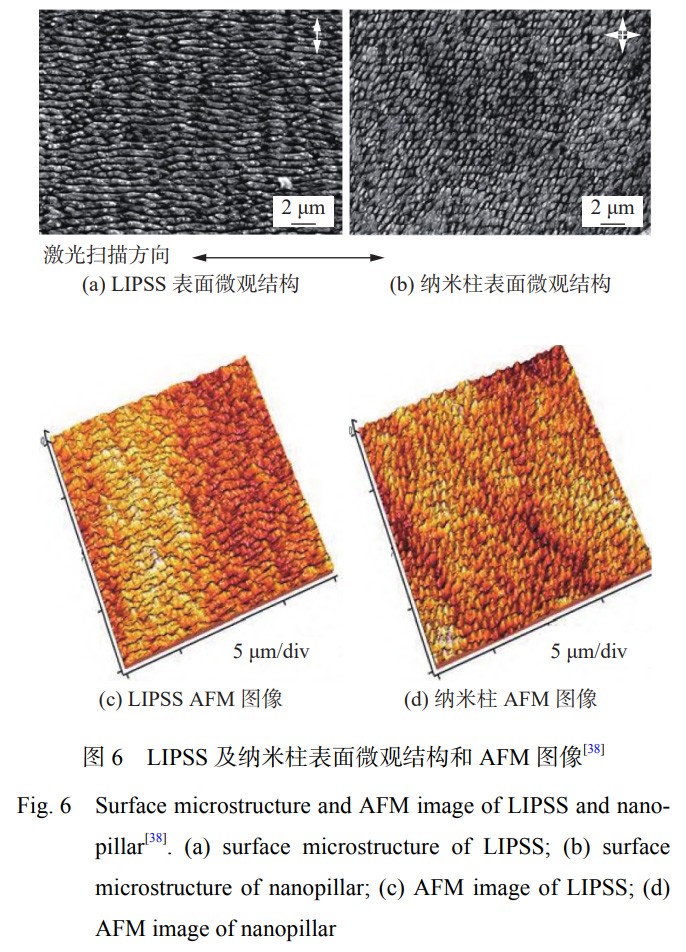
综上所述,激光表面处理后钛及钛合金表面结构对于减少细菌的黏附主要包括两方面:一是通过构建具有特征尺寸小于细菌尺寸和具有非常致密的特征表面,减少细菌与表面的接触面积,抑制细菌的定植或刺破细菌,达到减少细菌滞留的目的;二是通过增大表面的凹陷程度,细菌无法穿过凹陷与表面建立稳定的连接,导致细菌只能黏附在个别的尖端,防止生物膜的形成。
2.3 激光熔覆抗菌涂层
激光熔覆技术可以在钛及钛合金表面熔覆不同体系的成分,改善钛合金的性能。现阶段,激光熔覆技术用于提高钛及钛合金抗菌性能的熔覆体系主要包括生物医用金属材料(Ag,Cu,Nb,Zn,Ta等[48])、生物陶瓷(HA,TiO2等[49])。激光熔覆技术可以显著提高钛及钛合金的抗菌性能,尤其是对金黄色葡萄球菌和大肠杆菌等常见的致病菌有较好的抑制作用[50]。
2.3.1 Ag抗菌涂层
Ag具有超强的抗菌性,被广泛应用于广谱杀菌材料。SHI等学者[51]通过对高真空电弧炉熔炼的TiAg合金进行抗菌性试验,发现:合金的抗菌性是由于Ti2Ag和Ag+的共同作用,且没有引起细胞毒性。CHEN等学者[52]制成的Ti-Ag合金在经过热处理后,对金黄色葡萄球菌的抑制率高达99%。表明:Ag的加入可以使合金获得较强且稳定的抗菌性能。
XUE等学者[53]通过激光熔覆技术在Ti-20Zr10Nb-4Ta表面激光熔覆Ag箔,研究Ag微粒对于钛合金抗菌性和相容性的影响,试验结果表明:当激光功率为50W和70W时,经过处理的表面对于大肠杆菌的抑菌率分别达到96.3%和98.2%,对于金黄色葡萄球菌的抑菌率均达到100%,且随着激光功率的增加,表面形成了钝化膜,粗糙度增大,具有良好的耐腐蚀性能和生物相容性。ZHANG等学者[54]将Ag和ZnO纳米颗粒掺入羟基磷灰石纳米粉体中,通过激光熔覆技术沉积在TC4表面,对激光熔覆涂层的抗菌性能和骨整合性能进行研究。研究发现:纳米Ag和HA在熔覆层表面呈棒状,涂层与基体结合良好,最大熔深达到460μm,涂层的最小润湿角约为10.5°。激光熔覆可以将复合涂层紧密地固定在TC4基体上,抑制了Ag离子的释放速率,缓解了高Ag浓度下的细胞毒性[55],涂层具有优异的细菌抗性、成骨和骨整合能力。MAHARUBIN等学者[56]通过激光加工净成形工艺将混合均匀的cp-Ti粉和Ag粉采用同步送粉方式在cp-Ti基体上制备银含量(质量分数)为0.5%~2.0%的Ti-Ag合金,通过EDS检测发现:Ag均匀地分布在基体上。通过对不同Ag含量的试样进行金黄色葡萄球菌和铜绿假单胞菌进行抗菌性试验,抗菌效果随Ag含量的增加而增强,当Ag含量达到1.5%时,抗菌率分别达到99.79%和99.96%,且在Ag含量较低时,可以在不损害生物活性的前提下最小化细菌感染的风险。
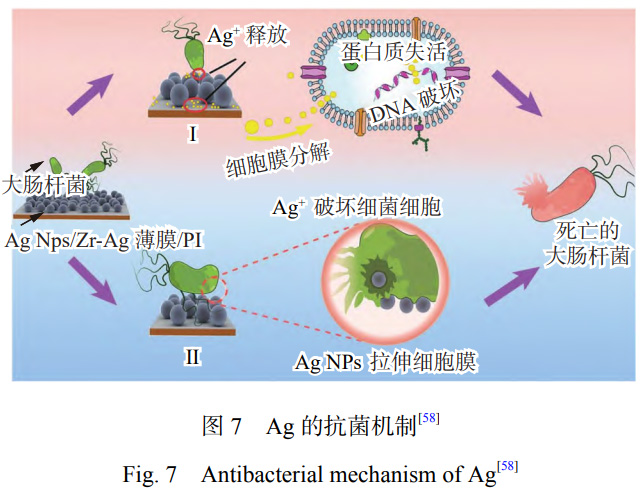
目前,关于Ag对微生物的抑制和杀伤途径主要归结为以下观点[57],其抗菌原理如图7[58]所示。Ag能够抗菌的主要原因是能被菌类吸附,带正电荷的Ag+能与带负电荷的微生物之间产生静电吸引,从而促使Ag+附着在细胞膜上[59],细菌的细胞膜在与Ag接触几分钟后就会被完全破坏[60]。同时,Ag能够与细菌的蛋白质相互结合,破坏蛋白质的结构,阻碍细菌的新陈代谢,从而失去活性[61]。Ag+浓度的提高会导致细胞氧化反应的增加,微生物细胞氧化应激的增加是Ag+引起毒性作用的标志。由于Ag能够促进细胞产生ROS和自由基,因此Ag具有强大的抗菌、抗真菌和抗病毒活性[62]。但是,抗菌性能与银含量不存在线性关系,银含量过高时,并不会显著提高钛合金的抗菌性能,反而可能产生细胞毒性[63]。
2.3.2 Cu抗菌涂层
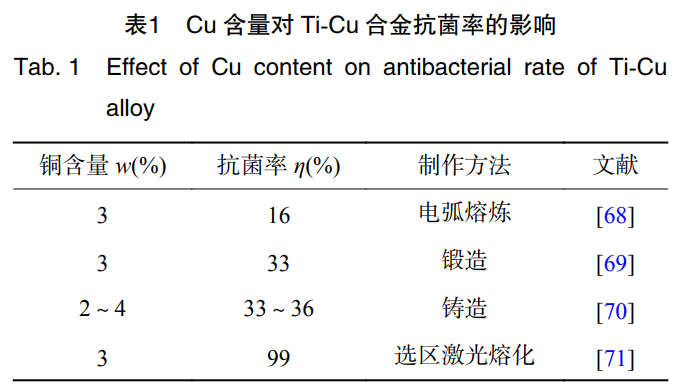
不同的金属材料杀菌能力也有所不同,其大小排序为:Cu>Fe>Sn>Al>Zn>Co[64]。Cu具有促进成骨细胞分化,诱导血管生长的作用。同时,作为人体必需的微量元素,有预防骨质疏松的作用[65]。ZHANG等学者[66]通过采用等离子烧结技术制备的Ti-Cu合金对大肠杆菌和金黄色葡萄球菌的抑制率达到99%。有研究报道,只有Ti-Cu合金的Cu含量(质量分数)在5%及以上,合金才具有抗菌率>99%的抗菌性能[67],表1为合金中Cu含量不同表现出的抗菌性能[68-71]。
JI等学者[72]采用激光选区熔化技术制备的Ti-(3,5,7,10)Cu合金(质量分数,%),Ti2Cu相在晶界预先形核并阻止晶粒长大,能够很好的起到细化晶粒的作用。同时,由于激光选区熔化快速凝固的特点,Ti的平均晶粒尺寸为7.4μm,远小于常规铸造Ti的晶粒尺寸,快速凝固导致表面收缩而产生的细小孔洞,增加了细菌与合金的接触面积,抗菌效果明显增加。合金具有较小的Cu2+释放且有较高的抗菌率。Ti-Cu合金与细菌细胞膜的直接相互作用导致膜的渗透性增强,细菌允许Cu2+进入细胞内,引起接触杀菌[73]。经过激光选区熔化形成的Ti-3Cu合金的抗菌率相对于相同成分的铸造合金,抗菌率提高约70%。
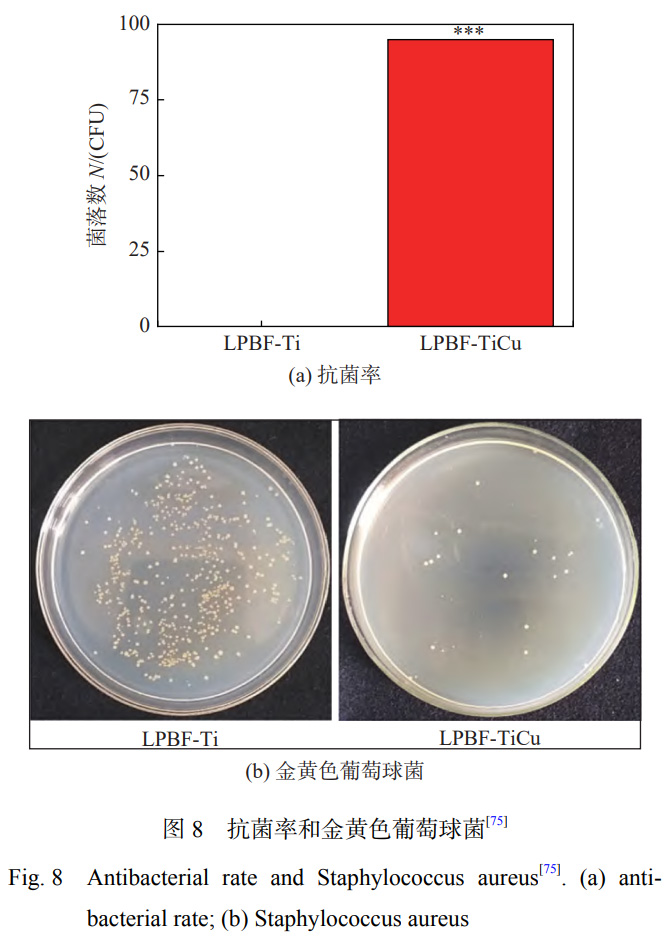
HOU等学者[74]通过激光熔覆技术在TC4表面原位制备掺杂Cu颗粒的Ca-Si基涂层,研究表明:激光处理后原位生成了Ca2SiO4,CaTiO3和Cu2O,涂层表现出良好的耐磨性和润湿性;当Cu含量达到15%时,复合涂层具有对大肠杆菌最高的抗菌活性。LIU等学者[75]利用激光粉末床熔合(LPBF)技术在纯钛基体上制备抗菌Ti-Cu合金(LPBF-TiCu),激光快速加热和冷却的优点相对于传统方法制作的Ti-Cu合金,会使Ti合金形成较多的针状马氏体(α′-Ti),由于其具有较低的能量状态,会减缓钛合金的腐蚀[76]。Cu的加入改善了LPBF-TiCu合金中马氏体相变时形状应变的自适应性,减少了位错在晶界的堆积。LPBFTiCu合金可以显著促进细胞的增殖,合金表面上的细胞具有更多的伪足,生物相容性良好,对金黄色葡萄球菌的抑制率达到94.81%,抗菌效果如图8所示。
目前,关于激光熔覆含Cu涂层多用于改变金属的耐磨性和耐腐蚀性[77−78],对于采用激光熔覆方式引入Cu提高植入物抗菌性能的研究较少。现阶段关于Cu2+的杀菌机理主要解释为含铜的抗菌金属材料在溶液或体液环境下溶出会释放带正电的Cu2+离子,而细菌的生物膜通常带负电荷,二者之间会产生吸附作用,从而导致细胞膜上的电荷分布不均匀,细菌形态在不均匀的库仑力作用下发生变形,细胞膜的渗透性改变,最终造成细菌壁和细菌膜的破裂,导致细胞质的溶出,从而杀死细菌[79]。
3、结束语
(1)激光表面改性诱导钛合金产生抗菌涂层的调控机理尚不明确,以及如何提升抗菌涂层制造技术的精确性,促进抗菌性和生物相容性更加协调,是现阶段钛合金激光表面改性的研究重点。
(2)虽然Ag,Cu等抗菌元素的抗菌性已经得到验证。但是,目前对于金属离子的抗菌机制及细胞毒性机制的研究尚不明确。不论是通过构建含有抗菌元素的抗菌涂层还是合金化处理,都需要保证植入物的长期无害性。因此,可以在保证抗菌元素的最小添加量下,同时加入多种微量抗菌元素。
(3)对于钛及钛合金的发展,仍然需要对引发炎症和细菌感染方面投入大量研究。钛合金的植入要在保证对人体组织长期无害的前提下,构建稳定且多功能的复合涂层以满足实际应用中的多种需求,是钛及钛合金在生物医用领域中未来研究的主要方向。
参考文献
[1]POU P, RIVEIRO A, DEL VAL J, et al. Laser surface texturing of titanium for bioengineering applications[J].Procedia Manufacturing, 2017, 13: 694 − 701.
[2]DU PLOOY R, AKINLABI E T. Analysis of laser cladding of titanium alloy[J]. Materials Today: Proceedings, 2018, 5(9): 19594 − 19603.
[3]孙壮, 王伟, 王成, 等. 钛合金表面激光熔覆耐磨和自润滑 涂层的研究进展 [J]. 材料保护, 2023, 56(1): 107 − 120.
SUN Zhuang, WANG Wei, WANG Cheng, et al. Research progress of wear-resistant and self-lubrication coatings prepared on titanium alloy surface by laser cladding[J]. Material Protection, 2023, 56(1): 107 − 120.
[4]LIU S Y, SHIN Y C. Additive manufacturing of Ti6Al4V alloy: A review[J]. Materials & Design, 2019, 164: 107552.
[5] 吴耀佳, 张懋达, 付永强, 等. 含 Ag 硬质涂层的结构及其 摩擦腐蚀与抗菌特性的研究进展 [J]. 表面技术, 2021, 50(1): 94 − 106, 161.
WU Yaojia, ZHANG Maoda, FU Yongqiang, et al. Research progress in structure, tribocorrosion and antibacterial properties of Ag-containing hard coatings[J]. Surface Technology, 2021, 50(1): 94 − 106, 161.
[6]APAZA-BEDOYA K, TARCE M, BENFATTI C A M, et al. Synergistic interactions between corrosion and wear at titanium-based dental implant connections: A scoping review[J]. Journal of Periodontal Research, 2017, 52(6): 946 − 954.
[7]CHAN C W, CARSON L, SMITH G C, et al. Enhancing the antibacterial performance of orthopaedic implant materials by fibre laser surface engineering[J]. Applied Surface Science, 2017, 404: 67 − 81.
[8]ZIMMERLI W. Clinical presentation and treatment of orthopaedic implant-associated infection[J]. Journal of Internal Medicine, 2014, 276(2): 111 − 119.
[9]CAMPOCCIA D, MONTANARO L, ARCIOLA C R. The significance of infection related to orthopedic devices and issues of antibiotic resistance[J]. Biomaterials, 2006, 27(11): 2331 − 2339.
[10]FLEMMING H C, VAN HULLEBUSCH E D, NEU T R. The biofilm matrix: multitasking in a shared space[J].Nature Reviews Microbiology, 2023, 21(2): 70 − 86.
[11]范竞一, 马迅, 李伟, 等. 医用钛合金表面改性技术研究进 展 [J]. 功能材料, 2022, 53(7): 7027 − 7039.
FAN Jingyi, MA Xun, LI Wei, et al. Research progress of surface modification technology of biomedical titanium alloy[J]. Journal of Functional Materials, 2022, 53(7): 7027 − 7039.
[12]NIE Bin’en, LONG Teng, AO Haiyong, et al. Covalent immobilization of enoxacin onto titanium implant surfaces for inhibiting multiple bacterial species infection and in vivo methicillin-resistant staphylococcus aureus infection prophylaxis[J]. Antimicrobial Agents and Chemotherapy, 2016, 60(1): e01766 − 16.
[13]ALT V, BITSCHNAU A, ÖSTERLING J, et al. The effects of combined gentamicin-hydroxyapatite coating for cementless joint prostheses on the reduction of infection rates in a rabbit infection prophylaxis model[J].Biomaterials, 2006, 27: 4627 − 4634.
[14]DONG Yaning, LIU Li, SUN Jin, et al. Phosphonate/quaternary ammonium copolymers as high-efficiency antibacterial coating for metallic substrates[J]. Journal of Materials Chemistry B, 2021, 9(39): 8321 − 8329.
[15] 秦思民. 基于生物被膜的耐药性抗菌剂研究和工程新材 料探索 [D]. 北京: 中国科学院大学, 2022.
QIN Simin. Research on drug-resistant antibacterial agents and exploration of new engineering materials based on biofilms[D]. Beijing, China: University of Chinese Academy of Sciences, 2022.
[16]王东生, 田宗军, 沈理达, 等. 激光熔覆技术研究现状及其 发展 [J]. 应用激光, 2012, 32(6): 538 − 544.
WANG Dongsheng, TIAN Zongjun, SHEN Lida, et al. Research status and development of laser cladding technology[J]. Applied Laser, 2012, 32(6): 538 − 544.
[17]崔振铎, 朱家民, 姜辉, 等. Ti 及钛合金表面改性在生物医 用领域的研究进展 [J]. 金属学报, 2022, 58(7): 837 − 856.
CUI Zhenduo, ZHU Jiamin, JIANG Hui, et al. Research progress of the surface modification of titanium and titanium alloys for biomedical application[J]. Acta Metallurgica Sinica, 2022, 58(7): 837 − 856.
[18]SIDDIQUI A A, DUBEY A K. Recent trends in laser cladding and surface alloying[J]. Optics & Laser Technology, 2021, 134: 106619.
[19]JU Jiang, ZAN Rui, SHEN Zhao, et al. Remarkable bioactivity, bio-tribological, antibacterial, and anti-corrosion properties in a Ti6Al4V-xCu alloy by laser powder bed fusion for superior biomedical implant applications[J].Chemical Engineering Journal, 2023, 471: 144656.
[20]张永康, 周建忠, 叶会霞, 等. 激光加工技术 [M]. 北京: 化 学工业出版社, 2006.
ZHANG Yongkang, ZHOU Jianzhong, YE Huixia, et al. Laser processing technology [M]. Beijing, China: Chemical Industry Press, 2006.
[21]SYPNIEWSKA J, SZKODO M. Influence of laser modification on the surface character of biomaterials: Titanium and its alloys-A review[J]. Coatings, 2022, 12: 1371.
[22]LIU Zhifang, NIU Tong, LEI Yaxi, et al. Metal surface wettability modification by nanosecond laser surface texturing: A review[J]. Biosurface and Biotribology, 2022(2): 95 − 120.
[23]XU Yong, LIU Wei, ZHANG Gangqiang, et al. Friction stability and cellular behaviors on laser textured Ti6Al4V alloy implants with bioinspired micro-overlapping structures[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 109: 103823.
[24] WANG Xinlin, LEI Lei, YU Han. A review on microstructural features and mechanical properties of wheels/rails cladded by laser cladding[J]. Micromachines, 2021, 12(2): 152.
[25] ZHANG Yifu, ZHANG Hua, ZHU Zhengqiang, et al.Microstructure, properties and first principles calculation of titanium alloy/steel by Nd: YAG laser self-fluxing welding[J]. China Welding, 2018, 27(3): 1 − 10.
[26]周佳良, 舒凤远, 赵洪运, 等. 激光熔覆在 AlN 陶瓷表面制 备铜基金属覆层缺陷分析及控制 [J]. 焊接学报, 2019, 40(11): 133 − 138.
ZHOU Jialiang, SHU Fengyuan, ZHAO Hongyun, et al. Analysis and control of defects in preparing copper-based metal coatings on AlN ceramic surface by laser cladding[J].Transactions of the China Welding Institution, 2019, 40(11): 133 − 138.
[27]袁庆龙, 冯旭东, 曹晶晶, 等. 激光熔覆技术研究进展 [J].材料导报, 2010, 24(3): 112 − 116.
YUAN Qinglong, FENG Xudong, CAO Jingjing, et al. Research progress of laser cladding technology[J]. Materials Reports, 2010, 24(3): 112 − 116.
[28]王垚. 喷射电沉积前处理的激光表面处理方法与试验研 究 [D]. 南京: 南京航空航天大学, 2019.
WANG Yao. Experimental Study on Laser surface treatment method of pre-electrodeposition[D]. Nanjing, China: Nanjing University of Aeronautics and Astronautics, 2019.
[29]林基辉, 刘德鑫, 李耀, 等. 激光合金化技术在表面改性中 的应用研究进展 [J]. 热加工工艺, 2020, 49(8): 13 − 16.
LIN Jihui, LIU Dexin, LI Yao, et al. Research Progress in application of laser alloying technology in surface modification[J]. Hot Working Technology, 2020, 49(8): 13 − 16.
[30]QIAO Q, CRISTINO V A M, TAM L M, et al. Characterization of laser surface-alloyed Ti-Ni-Ag coatings and evaluation of their corrosion and antibacterial performance[J]. Surface and Coatings Technology, 2023, 474: 130119.
[31]CHAN C W, LEE S, SMITH G, et al. Enhancement of wear and corrosion resistance of beta titanium alloy by laser gas alloying with nitrogen[J]. Applied Surface Science, 2016, 367: 80 − 90.
[32]SANTOS E C, MORITA M, SHIOMI M, et al. Laser gas nitriding of pure titanium using CW and pulsed Nd: YAG lasers[J]. Surface and Coatings Technology, 2006, 201: 1635 − 1642.
[33]邹洁, 陈洁, 胡滨. TiN 涂层对牙科钴铬合金抗菌腐蚀性能 的影响 [J]. 上海口腔医学, 2010, 19(2): 173 − 177.
ZOU Jie, CHEN Jie, HU Bin. Effect of titanium nitride coating on bacterial corrosion resistance of dental Co-Cr alloy[J]. Shanghai Journal of Stomatology, 2010, 19(2): 173 − 177.
[34] DONAGHY C L, MCFADDEN R, KELAINI S, et al. Creating an antibacterial surface on beta TNZT alloys for hip implant applications by laser nitriding[J]. Optics & Laser Technology, 2020, 121: 105793.
[35]肖忆楠, 乔岩欣, 李月明, 等. 医用钛及钛合金表面改性技 术的研究进展 [J]. 材料导报, 2019, 33(Z2): 336 − 342.
XIAO Yinan, QIAO Yanxin, LI Yueming, et al. Research development of surface modification technology of biomedical titanium and titanium alloy[J]. Materials Reports, 2019, 33(Z2): 336 − 342.
[36]FATHI-HAFSHEJANI P, JOHNSON H, AHMADI Z, et al. Phase-selective and localized TiO2 coating on additive and wrought titanium by a direct laser surface modification approach[J]. ACS Omega, 2020, 5(27): 16744 − 16751.
[37]PARMAR V, KUMAR A, SANKAR M M, et al. Oxidation facilitated antimicrobial ability of laser micro-textured titanium alloy against gram-positive Staphylococcus aureus for biomedical applications[J]. Journal of Laser Applications, 2018, 30(3): 032001.
[38]
CUNHA A, ELIE A M, PLAWINSKI L, et al. Femtosecond laser surface texturing of titanium as a method to reduce the adhesion of Staphylococcus aureus and biofilm formation[J]. Applied Surface Science, 2016, 360: 485 − 493.
[39]VARIOLA F, YI J H, RICHERT L, et al. Tailoring the surface properties of Ti6Al4V by controlled chemical oxidation[J]. Biomater, 2008, 29(10): 1285 − 1298.
[40]李华晨, 周广涛, 陈梅峰, 等. 分步气体介质下低功率激光 焊接薄板紫铜成形及组织和性能 [J]. 焊接学报, 2020, 41(10): 65 − 72.
LI Huachen, ZHOU Guangtao, CHEN Meifeng, et al. Research on laser welding formability and microstructure property of copper in stepwise gas medium[J]. Transactions of the China Welding Institution, 2020, 41(10): 65 − 72.
[41]GALLARDO-MORENO A M, PACHA-OLIVENZA M A, SALDAÑA L, et al. In vitro biocompatibility and bacterial adhesion of physico-chemically modified Ti6Al4V surface by means of UV irradiation[J]. Acta Biomaterialia, 2009, 5(1): 181 − 192.
[42]MITIK-DINEVA N, WANG J, TRUONG V K, et al. Escherichia coli, Pseudomonas aeruginosa, and Staphylococcus aureus attachment patterns on glass surfaces with nanoscale roughness[J]. Current Microbiology, 2009, 58: 268 − 273.
[43] JEYACHANDRAN Y L, NARAYANDASS S K. The effect of thickness of titanium nitride coatings on bacterial adhesion[J]. Trends in Biomaterials and Artificial Organs, 2010, 24(2): 90 − 93.
[44] GIRALDEZ M J, RESUA C G, LIRA M, et al. ContactLens hydrophobicity and roughness effects on bacterial adhesion[J]. Optometry and Vision Science, 2010, 87(6): E426 − E431.
[45]POGODIN S, HASAN J, BAULIN V A, et al. Biophysical model of bacterial cell interactions with nanopatterned cicada wing surfaces[J]. Biophysical Journal, 2013, 104(4): 835 − 840.
[46]TRUONG V K, LAPOVOK R, ESTRIN Y S, et al. The influence of nano-scale surface roughness on bacterial adhesion to ultrafine-grained titanium[J]. Biomaterials, 2010, 31(13): 3674 − 3683.
[47]BRAEM A, VAN MELLAERT L, MATTHEYS T, et al. Staphylococcal biofilm growth on smooth and porous titanium coatings for biomedical applications[J]. Journal of Biomedical Materials Research Part A, 2014, 102: 215 − 224.
[48]司银芳, 胡语婕, 张凡, 等. 生物合成氧化锌纳米颗粒材料 及其抗菌应用 [J]. 化工进展, 2023, 42(4): 2013 − 2023.
SI Yinfang, HU Yujie, ZHANG Fan, et al. Biosynthesis of zinc oxide nanoparticles and its application to antibacterial[J]. Chemical Industry and Engineering Progress, 2023, 42(4): 2013 − 2023.
[49]许晴. 生物活性陶瓷复合材料制备及其抗菌和再生修复 研究 [D]. 北京: 中国科学院大学, 2021.
XU Qing. Preparation of bioactive ceramic composites and its antibacterial activity and regenerative repair effect[D]. Beijing, China: University of Chinese Academy of Sciences, 2021.
[50]ZHOU Yazhou, YANG Juan, HE Tingting, et al. Highly stable and dispersive silver nanoparticle-graphene composites by a simple and low-energy-consuming approach and their antimicrobial activity[J]. Small, 2013, 9(20): 3445 − 3454.
[51]SHI Anqi, ZHU Chenshun, FU Shan, et al. What controls the antibacterial activity of Ti-Ag alloy, Ag ion or Ti2Ag particles?[J]. Materials Science and Engineering: C, 2020, 109: 110548.
[52]CHEN Mian, YANG Lei, ZHANG Lan, et al. Effect of nano/micro-Ag compound particles on the bio-corrosion, antibacterial properties and cell biocompatibility of Ti-Ag alloys[J]. Materials Science and Engineering: C, 2017, 75: 906 − 917.
[53]XUE Xianda, LU Libin, HE Donglei, et al. Antibacterial properties and cytocompatibility of Ti-20Zr-10Nb-4Ta alloy surface with Ag microparticles by laser treatment[J]. Surface and Coatings Technology, 2021, 425: 27716.
[54] ZHANG Yanzhe, LIU Xiangmei, LI Zhaoyang, et al. Nano Ag/ZnO-incorporated hydroxyapatite composite coatings: highly effective infection prevention and excellent osteointegration[J]. ACS Applied Materials & Interfaces, 2018, 10(1): 1266 − 1277.
[55]丁婷婷. 含银纳米材料的制备、抗菌性能及细胞毒性研 究 [D]. 长沙: 湖南大学, 2020.
DING Tingting. Preparation, antibacterial properties and cytotoxicity of silver-containing nanomaterials[D]. Changsha, China: Hunan University, 2020.
[56]MAHARUBIN S, HU Y B, SOORIYAARACHCHI D. Laser engineered net shaping of antimicrobial and biocompatible titanium-silver alloys[J]. Materials Science and Engineering: C, 2019, 105: 110059.
[57]李波. 基于银基纳米复合生物材料靶向协同抗菌用于骨 感染治疗 [D]. 上海: 东华大学, 2022.
LI Bo. Targeted synergistic antibacterial based on silverbased nanocomposite biomaterials for bone infection treatment[D]. Shanghai, China: Donghua University, 2022.
[58]SHI Pengyan, SUN Haoliang, ZHANG Haoge, et al. Highly effective antibacterial properties of self-formed Ag nanoparticles/Zr-Ag granular films[J]. Applied Surface Science, 2023, 622: 156929.
[59]ABBASZADEGAN A, GHAHRAMANI Y, GHOLAMI A, et al. The effect of charge at the surface of silver nanoparticles on antimicrobial activity against gram-positive and gram-negative bacteria: A preliminary study[J]. Journal of Nanomaterials, 2015, 2015: 720654.
[60]RAFFI M, HUSSAIN F, BHATTI T M, et al. Antibacterial characterization of silver nanoparticles against E. coli ATCC15224[J]. Journal of Materials Science & Technology, 2008, 24(2): 192 − 196.
[61]张俊敏. Ti-Ta-Ag 合金的放电等离子体烧结合成机理及 其性能研究 [D]. 昆明: 昆明理工大学, 2022.
ZHANG Junmin. Study on the synthesis mechanism and properties of Ti-Ta-Ag alloy by spark plasma sintering[D]. Kunming, China: Kunming University of Science and Technology, 2022.
[62]KIM S, LEE H S, RYU D, et al. Antibacterial activity of silver-nanoparticles against Staphylococcus aureus and Escherichia coli[J]. Korean Journal of Microbiology & Biotechnology, 2011, 39(1): 77 − 85.
[63]FENG Q L, WU J, CHEN G Q, et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal of Biomedical Materials Research, 2000, 52(4): 662 − 668.
[64]
罗娟. 纳米 Ag-Cu 基抗菌材料的制备及其性能研究 [D].昆明: 昆明理工大学, 2022.
LUO Juan. Preparation and properties of nano Ag-Cu based antibacterial materials[D]. Kunming, China: Kunming University of Science and Technology, 2022.
[65]SRIKANT P, REDDY C K, RAM N R. Metallic particulates for preparation of anti-bacterial preservation vassals and their applications-A review[J]. Materials Today: Proceedings, 2019, 18: 440 − 444.
[66]ZHANG Erlin, FU Shan, WANG Ruoxian, et al. Role of Cu element in biomedical metal alloy design[J]. Rare Metals, 2019, 38(6): 476 − 494.
[67]ZHANG Erlin, LI Shengyi, REN Jing, et al. Effect of extrusion processing on the microstructure, mechanical properties, biocorrosion properties and antibacterial properties of Ti-Cu sintered alloys[J]. Materials Science and Engineering: C, 2016, 69: 760 − 768.
[68]LIU Jie, LI Fangbing, LIU Cong, et al. Effect of Cu content on the antibacterial activity of titanium-copper sintered alloys[J]. Materials Science and Engineering: C, 2014, 35: 392 − 400.
[69]FOWLER L, JANSON O, ENGQVIST H, et al. Antibacterial investigation of titanium-copper alloys using luminescent Staphylococcus epidermidis in a direct contact test[J].Materials Science and Engineering: C, 2019, 97: 707 − 714.
[70]BAO Mianmian, LIU Ying, WANG Xiaoyan, et al. Optimization of mechanical properties, biocorrosion properties and antibacterial properties of wrought Ti-3Cu alloy by heat treatment[J]. Bioactive Materials, 2018, 3(1): 28 − 38.
[71]ZHANG Erlin, REN Jing, LI Shengyi, et al. Optimization of mechanical properties, biocorrosion properties and antibacterial properties of as-cast Ti-Cu alloys[J].Biomedical Materials, 2016, 11: 065001.
[72]JI Hairui, ZHAO Mingchun, XIE Bin, et al. Corrosion and antibacterial performance of novel selective-laser-melted (SLMed) Ti-xCu biomedical alloys[J]. Journal of Alloys and Compounds, 2021, 8644: 158415.
[73]PENG Cong, ZHANG Shuyuan, SUN Ziqing, et al. Effect of annealing temperature on mechanical and antibacterial properties of Cu-bearing titanium alloy and its preliminary study of antibacterial mechanism[J]. Materials Science andEngineering: C, 2018, 93: 495 − 504.
[74]HOU Baoping, YANG Zhao, YANG Yuling, et al. In vitro bioactivity, tribological property, and antibacterial ability of Ca-Si-based coatings doped with cu particles in-situ fabricated by laser cladding[J]. Applied Physics A, 2018, 124: 256.
[75]LIU Hui, SHI Lizhen, LIU Huan, et al. Corrosion behavior of laser powder bed fusion prepared antibacterial Cu-bearing titanium alloy[J]. Materials Letters, 2023, 331: 133496.
[76]KASCHEL F R, KEAVENEY S, DOWLING D P. Comparison between continuous and modulated wave laser emission modes for the selective laser melting of Ti-6Al-4V: Dimensional accuracy, microstructure and mechanical behaviour[J]. Additive Manufacturing, 2022, 55: 102825.
[77]谢发勤, 何鹏, 吴向清, 等. 钛合金表面激光熔覆技术的研 究及展望 [J]. 稀有金属材料与工程, 2022, 51(4): 1514 − 1524.
XIE Fanqin, HE Peng, WU Xiangqing, et al. Research and prospect of laser cladding technology on titanium alloy surface[J]. Rare Metal Materials and Engineering, 2022, 51(4): 1514 − 1524.
[78]黄湘湘. 碳钢表面激光熔覆铝青铜合金组织和性能研究[D]. 上海: 上海交通大学, 2019.
HUANG Xiangxiang. Microstructure and properties of laser cladded aluminum bronze coating on carbon steel[D]. Shanghai, China: Shanghai Jiao Tong University, 2019.
[79]王亚迪. 基于阳离子-π 作用的铜复合物的抗菌性能与机 理研究 [D]. 北京: 中国科学院大学, 2020. WANG Yadi. Copper complexes based on cation-π interaction: Preparation characterization and antimicrobial activities[D]. Beijing, China: University of Chinese Academy of Sciences, 2020.
第一作者: 马振,博士,副教授;主要从事医用钛合金表面 改性的科研和教学工作;已发表论文 20 余篇;jmsdxmz@163.com。通信作者: 牟立婷,博士,副教授;主要从事医用生物材料 研究;muliting@163.com。
相关链接